中学受験理科講座 水溶液の性質(1)
水溶液の性質(1) 解説動画
水溶液の性質 一問一答プリントはこちらをクリック
水溶液の分類


色による分類
水溶液ってなんだっけ?

はるか

Haru_You
物質が水に均一に溶け、透明でどこも同じ濃さになったものが水溶液だね。
にごった液体は水に溶けない固体が目に見えているってことになるから、水溶液とはよばないんだよ。
にごった液体は水に溶けない固体が目に見えているってことになるから、水溶液とはよばないんだよ。
水溶液はみんな透明なの?
そしたら、水溶液を見た目で判別することは難しいね。
そしたら、水溶液を見た目で判別することは難しいね。

はるか

Haru_You
ほとんどの水溶液は無色透明だから、見ただけじゃわからないね。
だけど、青色の硫酸銅水溶液や、赤色の塩化コバルト水溶液のように色がついていても透明な水溶液もあるんだよ。
だけど、青色の硫酸銅水溶液や、赤色の塩化コバルト水溶液のように色がついていても透明な水溶液もあるんだよ。
においによる分類

Haru_You
水溶液の中にはにおいがあるものもあるんだ。
中学受験の理科ではアンモニア水、塩酸、さく酸水溶液、アルコール水溶液がにおいのある水溶液の代表だね。
中学受験の理科ではアンモニア水、塩酸、さく酸水溶液、アルコール水溶液がにおいのある水溶液の代表だね。
においって、どんなにおいなの?

はるか

Haru_You
水溶液によってにおいも異なるんだけど、アンモニア水・塩酸・さく酸水溶液は「鼻を刺す刺激臭」と表現するね。
さく酸水溶液って料理で使うお酢のことだから、あんな感じのツーンとするにおいだよ。
アルコールは「独特のにおい」と表現されるね、お酒や消毒で使うあのアルコールのにおい。
さく酸水溶液って料理で使うお酢のことだから、あんな感じのツーンとするにおいだよ。
アルコールは「独特のにおい」と表現されるね、お酒や消毒で使うあのアルコールのにおい。
じゃあ、においをかげばその水溶液がなんなのか、分類できるってことだよね。

はるか

Haru_You
そうなんだけど、水溶液のにおいは直接かいじゃダメだよ。
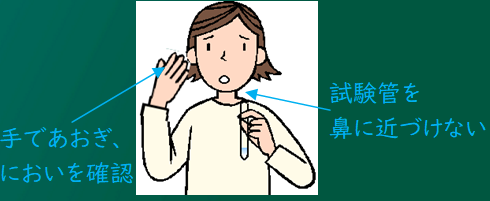
水溶液の入った試験管を鼻から遠ざけ、手であおいでにおいを確認するんだ。
においが鼻に届くってことはその物質が体内に入っているわけだから、アンモニアのように人体に有毒な物質もあるので扱いには気をつけること。
水溶液の入った試験管を鼻から遠ざけ、手であおいでにおいを確認するんだ。
においが鼻に届くってことはその物質が体内に入っているわけだから、アンモニアのように人体に有毒な物質もあるので扱いには気をつけること。
溶質による分類
水溶液って、なにかが溶けた液体なんだよね。
だったら、熱して水を蒸発させれば、中に何が溶けていたのかわかるんじゃないかな?
だったら、熱して水を蒸発させれば、中に何が溶けていたのかわかるんじゃないかな?

はるか

Haru_You
水溶液に溶けているのが固体の物質なら、水を蒸発させると固体が現れるね。
でも、気体や液体が溶けた水溶液では、蒸発後に何も残らないよ。
でも、気体や液体が溶けた水溶液では、蒸発後に何も残らないよ。
なら、固体が溶けていたかどうかの分類はできるってことだよね。
固体が溶けている水溶液にはどんなものがあるの?
固体が溶けている水溶液にはどんなものがあるの?

はるか

Haru_You
食塩水、石灰水、水酸化ナトリウム水溶液、重そう水溶液、ホウ酸水溶液、それに砂糖水が固体の溶けた水溶液の代表だね。
このうち砂糖水以外は加熱して蒸発させると白い固体が現れるんだけど、砂糖水だけは黒い固体が現れるんだよ。
このうち砂糖水以外は加熱して蒸発させると白い固体が現れるんだけど、砂糖水だけは黒い固体が現れるんだよ。
それって、黒砂糖をとかしたただけじゃないの?

はるか

Haru_You
いや、砂糖には成分に炭素が含まれるから、白い砂糖でも、加熱すると黒い炭になるんだよ。
ほら、プリンの上にかかったカラメルソース。あれは砂糖を加熱して黒くなっているんだよ。
ほら、プリンの上にかかったカラメルソース。あれは砂糖を加熱して黒くなっているんだよ。
じゃあ、逆に液体や気体が溶けている水溶液にはどんなものがあるの?

はるか

Haru_You
液体が溶けている水溶液はさく酸とアルコールくらいしか出てこないね。
気体が溶けているのは塩酸、炭酸水、アンモニア水が代表だね。
固体が溶けているものより少ないから、はじめにこっちを覚えてもいいね。
気体が溶けているのは塩酸、炭酸水、アンモニア水が代表だね。
固体が溶けているものより少ないから、はじめにこっちを覚えてもいいね。
酸性・中性・アルカリ性

Haru_You
水溶液には酸性・中性・アルカリ性という3つの液性があって、全ての水溶液がその3つのどれかに分類されるんだよ。
その3つの液性って、どうやって決まって、どんな違いがあるの?

はるか

Haru_You
専門的な話をすると、水素イオン指数(pH)が小さいものが酸性で大きいものがアルカリ性なんだけど、これは知らなくてもいいな。
中学受験レベルでいえば、酸性ってのはレモン水のように酸っぱくて、アルカリ性ってのは石けん水のように苦いものって考えてもいいよ。
中性ってのはそのどっちでもないもの、食塩水や砂糖水、アルコール水溶液なんかだね。
中学受験レベルでいえば、酸性ってのはレモン水のように酸っぱくて、アルカリ性ってのは石けん水のように苦いものって考えてもいいよ。
中性ってのはそのどっちでもないもの、食塩水や砂糖水、アルコール水溶液なんかだね。
そういえば、さっき塩酸とかさく酸とか、水溶液の名前が出てきたけど、それってやっぱり酸性?

はるか

Haru_You
うん、酸性の水溶液は、名前の最後が○○酸、または○○酸水だね。だけど、水酸化○○ってのはアルカリ性だから間違えないようにね。
電解質水溶液

Haru_You
あとは、水溶液が電気を流すかどうかを調べることでも、水溶液を分類することができるよ。
でも、水なんだからみんな電気が流れるんじゃないの?
ほら、みずポケモンはでんきで「こうかは ばつぐんだ!」になるし。
ほら、みずポケモンはでんきで「こうかは ばつぐんだ!」になるし。

はるか

Haru_You
いや、実は純粋な水(蒸留水)はあまり電気を流さないんだよ。
水に溶けたときに電流を流す物質を電解質といって、ただの水も電解質を微量に含んでいるから電気を流すんだ。
水に溶けたときに電流を流す物質を電解質といって、ただの水も電解質を微量に含んでいるから電気を流すんだ。
じゃあ、水に溶けて電気を流さない物質ってのもあるの?

はるか

Haru_You
水に溶けて電気を流さないものを非電解質というんだ。
非電解質の水溶液は、中性の砂糖水(デンプンなど糖類)とアルコール水溶液、過酸化水素水の3つだけ覚えておけばいいよ。逆に言うと酸性とアルカリ性の水溶液は全て電解質で電気を流すし、食塩水も中性だけど電気を流すってことだね。
非電解質の水溶液は、中性の砂糖水(デンプンなど糖類)とアルコール水溶液、過酸化水素水の3つだけ覚えておけばいいよ。逆に言うと酸性とアルカリ性の水溶液は全て電解質で電気を流すし、食塩水も中性だけど電気を流すってことだね。
液性と指示薬


リトマス試験紙
酸性・中性・アルカリ性って酸っぱいか苦いかって言ってたけど、なめて確かめるしかないの?

はるか

Haru_You
いや、液性を調べる指示薬というものがあるんだ。
有名なものには、リトマス試験紙なんてのがあるね。
有名なものには、リトマス試験紙なんてのがあるね。
リトマスってなに?
遊戯王に出てきた死の剣士のこと?
遊戯王に出てきた死の剣士のこと?

はるか

Haru_You
その元ネタだけどね、リトマスゴケという植物から取った色素がしみこんだ紙片がリトマス試験紙だよ。
水溶液をガラス棒の先につけてリトマス試験紙につけると、液性によってリトマス紙の色が変化するんだ。
青色のリトマス紙は酸性水溶液をつけると赤く変色し、中性とアルカリ性では青いまま。赤色のリトマス紙はアルカリ性水溶液をつけると青く変色し、中性と酸性では赤いままになるんだ。
水溶液をガラス棒の先につけてリトマス試験紙につけると、液性によってリトマス紙の色が変化するんだ。
青色のリトマス紙は酸性水溶液をつけると赤く変色し、中性とアルカリ性では青いまま。赤色のリトマス紙はアルカリ性水溶液をつけると青く変色し、中性と酸性では赤いままになるんだ。
酸性が赤くなって、アルカリ性が青くなるってことだね。

はるか

Haru_You
うん、赤い梅干し食べて酸っぱい酸性と、苦いアルカリ性で顔が青くなるってイメージで覚えておくといいよ。
BTB液

Haru_You
リトマス紙は簡単に判定できるんだけど、液体をガラス棒につけてからリトマス紙につけるという操作があるから、水溶液を混ぜたときの液性の変化を見るのには向いてないんだ。
そこで、水溶液の液性の変化を見るときにはBTB液というものを使うんだ。
これは液体だから、水溶液に混ぜて使えるんだよ。
そこで、水溶液の液性の変化を見るときにはBTB液というものを使うんだ。
これは液体だから、水溶液に混ぜて使えるんだよ。
BTB?旅行会社みたいな名前だね。

はるか

Haru_You
BTBはブロモティモールブルーの略だね。
このBTB液は、何も加えないとき、または加えた水溶液が中性のときは緑色をしているんだ。で、BTB液に加えた水溶液が酸性だと黄色になり、アルカリ性だと青色になるんだよ。
このBTB液は、何も加えないとき、または加えた水溶液が中性のときは緑色をしているんだ。で、BTB液に加えた水溶液が酸性だと黄色になり、アルカリ性だと青色になるんだよ。
酸性で黄色、中性で緑色、アルカリ性で青色だね。

はるか

Haru_You
これは「緑の中を歩く青木さん」って覚えておいて。「緑の中」を「アルく青」「黄酸」だよ。
ムラサキキャベツ液

Haru_You
BTB液と同じように使える液体の指示薬に、ムラサキキャベツ液というものもあるんだ。
紫キャベツって、あのサラダに入ってるやつ?

はるか

Haru_You
うん、別にムラサキキャベツじゃなくても、ブドウの皮でもブルーベリーでもアサガオの花でも、紫色をしたアントシアニンという色素を含んでいればなんでもいいんだ。
湯せんしたアルコールに紫の植物を入れて色素をとかすだけでできるから、自由研究でもよく使われるね。
湯せんしたアルコールに紫の植物を入れて色素をとかすだけでできるから、自由研究でもよく使われるね。
で、ムラサキキャベツ液はどんなふうに色が変わるの?
中性のときは紫色なんだよね、きっと。
中性のときは紫色なんだよね、きっと。

はるか

Haru_You
そうだね、ムラサキキャベツ液は強い酸性で赤色、弱い酸性でピンク色、中性で紫色、弱いアルカリ性で緑色、強いアルカリ性で黄色に変わるんだ。
実は紅ショウガの赤色って、このムラサキキャベツ液でつけているんだよ。
実は紅ショウガの赤色って、このムラサキキャベツ液でつけているんだよ。
あ、紅ショウガは酸っぱいから酸性だもんね。
じゃあさ、紅ショウガにアルカリ性の水溶液をかけたら緑色になる?
じゃあさ、紅ショウガにアルカリ性の水溶液をかけたら緑色になる?

はるか

Haru_You
うん、緑色に変わるよ。
あとはパンやケーキをふくらませるベーキングパウダーはアルカリ性の重そうを含んでいるから、ブルーベリー入りケーキを重そうを多めにして焼くと緑色に変わるね。
ちなみに、ムラサキキャベツ液の色変化は「赤ピン村のミッキー」とか「赤ちゃんピンチに群がるミッキー」とか覚えておいてね。
あとはパンやケーキをふくらませるベーキングパウダーはアルカリ性の重そうを含んでいるから、ブルーベリー入りケーキを重そうを多めにして焼くと緑色に変わるね。
ちなみに、ムラサキキャベツ液の色変化は「赤ピン村のミッキー」とか「赤ちゃんピンチに群がるミッキー」とか覚えておいてね。
フェノールフタレイン液

Haru_You
それから、フェノールフタレイン液という指示薬もあって、これは酸性と中性のときは無色なんだけど、アルカリ性のときだけ赤色になるんだよ。
アルカリ性しかわからないんだったら、前の2つを使った方がよくない?

はるか

Haru_You
この指示薬はアルカリ性になるとそれまで無色だったのが急に色が変わるから、アルカリ性になるってわかってる実験で使うことが多いんだ。
一番よく使うのが「アンモニア噴水」だね。
一番よく使うのが「アンモニア噴水」だね。
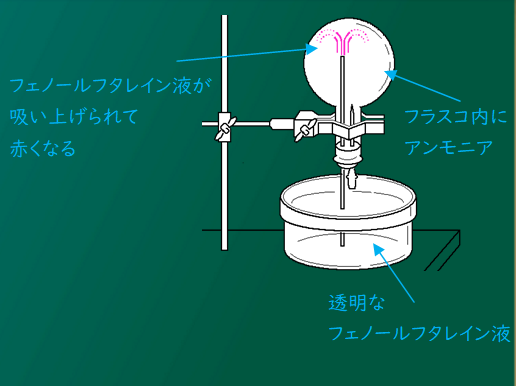
アンモニア噴水って、なんで下からフェノールフタレイン液が吸い上げられるの?

はるか

Haru_You
フラスコの中に満たしたアンモニアは水にとてもよく溶けるから、スポイトで1滴水を送るとアンモニアが溶け、フラスコ内の気圧が急激に下がるんだ。
それで下からフェノールフタレイン液を吸い上げて噴水のようになるんだけど、フラスコ内に入るとアルカリ性のアンモニアと反応するから、赤く変色するんだよ。
それで下からフェノールフタレイン液を吸い上げて噴水のようになるんだけど、フラスコ内に入るとアルカリ性のアンモニアと反応するから、赤く変色するんだよ。
試験によく出る11種類の水溶液の特徴

酸性水溶液の識別
指示薬で液性がわかったあとは、どこを見れば水溶液の種類を区別して決められるのかな?

はるか

Haru_You
たとえば、水溶液が酸性だってわかったとしようか。
試験によく出る水溶液のなかで、酸性のものは4種類。
そのうち、塩酸・炭酸水・さく酸は溶質が気体・液体なので蒸発させても何も残らないんだけど、ホウ酸水だけが固体が溶けた酸性水溶液なのですぐにわかるよ。
試験によく出る水溶液のなかで、酸性のものは4種類。
そのうち、塩酸・炭酸水・さく酸は溶質が気体・液体なので蒸発させても何も残らないんだけど、ホウ酸水だけが固体が溶けた酸性水溶液なのですぐにわかるよ。
じゃあ残り3つ、塩酸・炭酸水・さく酸の区別はどうするの?

はるか

Haru_You
炭酸水は溶質が二酸化炭素で、においがしないね。また、「水溶液どうしを混ぜたら白く濁った」という記述があったら、混ぜたのは炭酸水と石灰水で決まりだね。
塩酸とさく酸は蒸発させても何も残らないし、どちらもにおいがあるから区別できないね。

はるか

Haru_You
塩酸はアルミニウム・亜鉛・鉄をとかして水素を発生させるという性質があるから、そこで区別しよう。
あとは、「水溶液どうしを混ぜたら他の水溶液と同じ水溶液ができた」とあったら、塩酸+水酸化ナトリウム水溶液→食塩水ができる、という反応で決まり。
塩酸の溶質は気体の塩化水素っていうのが試験ではよく書かされるので覚えておくこと。
あとは、「水溶液どうしを混ぜたら他の水溶液と同じ水溶液ができた」とあったら、塩酸+水酸化ナトリウム水溶液→食塩水ができる、という反応で決まり。
塩酸の溶質は気体の塩化水素っていうのが試験ではよく書かされるので覚えておくこと。
中性水溶液の識別

Haru_You
中性水溶液で試験によくでるのは食塩水・砂糖水・アルコール水溶液の3種類。
うち、においがある中性水溶液はアルコールだけ。また、蒸発させて固体が残らない中性水溶液もアルコールだけだね。
うち、においがある中性水溶液はアルコールだけ。また、蒸発させて固体が残らない中性水溶液もアルコールだけだね。
食塩水と砂糖水はどっちも蒸発させると固体が出てくるよね。

はるか

Haru_You
だけど、黒い固体が残ったら砂糖水で決定。
または、電気が流れる中性水溶液なら食塩水で決定していいよ。
または、電気が流れる中性水溶液なら食塩水で決定していいよ。
ほんとは今あげた3つ以外にも、中性水溶液はあるんでしょ?

はるか

Haru_You
うん、過酸化水素水がたまに出てくるね。
溶質は液体でにおいなし、非電解質と特徴があまりない。
でも、過酸化水素水は二酸化マンガンとセットで出てくるから、中性水溶液から気体(酸素)が発生したら思い出してね。
溶質は液体でにおいなし、非電解質と特徴があまりない。
でも、過酸化水素水は二酸化マンガンとセットで出てくるから、中性水溶液から気体(酸素)が発生したら思い出してね。
アルカリ性水溶液の識別
アルカリ性の水溶液で試験に出るのは、何種類くらいあるの?

はるか

Haru_You
試験によく出るアルカリ性水溶液は、アンモニア水・水酸化ナトリウム水溶液・石灰水・重そう水溶液の4種類だね。
そのうち、アンモニア水だけがにおいのある、蒸発させて何も残らないアルカリ性の水溶液だからこれはすぐ見分けられるよ。
そのうち、アンモニア水だけがにおいのある、蒸発させて何も残らないアルカリ性の水溶液だからこれはすぐ見分けられるよ。
他の3つは、どれも白い固体が溶けててにおいがないんだね。区別しにくいな。

はるか

Haru_You
水酸化ナトリウム水溶液はアルミニウム・亜鉛をとかして気体を発生させる性質で見分けるよ。
また、石灰水は炭酸水と混ぜて白く濁る性質で見分けることができるよ。
また、石灰水は炭酸水と混ぜて白く濁る性質で見分けることができるよ。
で、どれにも引っかからなかったら重そう水溶液か。

はるか
水溶液の識別の例題

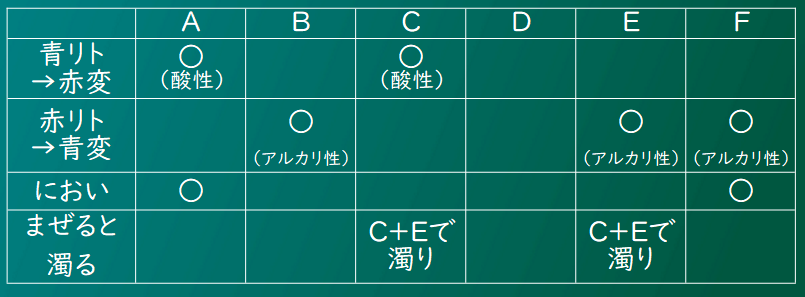
えーと、AとCは酸性で、BとEとFがアルカリ性か。
でもってAとFがにおいがあって・・・これを用意された6つの水溶液と組み合わせるのか。
条件が多くてややこしいなあ。
でもってAとFがにおいがあって・・・これを用意された6つの水溶液と組み合わせるのか。
条件が多くてややこしいなあ。

はるか

Haru_You
この問題は慣れないとややこしく見えるんだけど、条件が多いほどヒントが多いわけだから解きやすくなるんだよ。
これはね、バラバラに考えると面倒だから、まず水溶液にした実験の結果を表にまとめるんだ。
これはね、バラバラに考えると面倒だから、まず水溶液にした実験の結果を表にまとめるんだ。
え、表なんか書いたら時間かかるし、よけいに面倒くさくない?

はるか

Haru_You
実験1つ1つをバラバラに見ていくと混乱するから、「酸性で固体」とか「電気を通して中性」みたいにひとまとめにするには表にするのがいいんだよ。
何度も問題を読み返すと、結果として時間がかかるしね。
また、実際の試験ではここにさらに小問がくっついてくることが多いから、先に一目で見てわかるようにしておくと後がスムーズに解答できるってのもあるね。
何度も問題を読み返すと、結果として時間がかかるしね。
また、実際の試験ではここにさらに小問がくっついてくることが多いから、先に一目で見てわかるようにしておくと後がスムーズに解答できるってのもあるね。
たしかに、表だと一目でわかりやすくなるね。

はるか

Haru_You
表にしたあとは、問題で用意された水溶液を分類するんだ。
ここでは中性が食塩水だけ、酸性が炭酸水と塩酸だよね。
ここでは中性が食塩水だけ、酸性が炭酸水と塩酸だよね。
じゃあ、Dが食塩水で決定だね。
あとは酸性の2つだけど、においがあるのは塩酸だからAが塩酸、Cが炭酸水だ。
あとは酸性の2つだけど、においがあるのは塩酸だからAが塩酸、Cが炭酸水だ。

はるか

Haru_You
そうそう、表にすれば全体が一気に決まっていくんだよ。
Cの炭酸水と混ぜるEが石灰水だよね。
アルカリ性でにおいがあるFはアンモニア水で、残ったBが水酸化ナトリウム水溶液だね。
なんか、パズル解くみたいだね、これ。
アルカリ性でにおいがあるFはアンモニア水で、残ったBが水酸化ナトリウム水溶液だね。
なんか、パズル解くみたいだね、これ。

はるか
中和

中和と中性

Haru_You
酸性の水溶液とアルカリ性の水溶液を混ぜ合わせたときに、互いの性質を打ち消し合う反応を中和というんだ。
じゃあ、混ぜたら中和して中性になるってこと?

はるか

Haru_You
いや、中和したら中性になるわけじゃないよ。
だって100リットルの炭酸水に1滴の石灰水を混ぜたって、まだ炭酸水のままでしょ。
中和する量の比は水溶液の種類や濃さで決まって、それより酸性水溶液が多ければ酸性のままに、アルカリ性水溶液が多ければアルカリ性のままでいるんだよ。
だって100リットルの炭酸水に1滴の石灰水を混ぜたって、まだ炭酸水のままでしょ。
中和する量の比は水溶液の種類や濃さで決まって、それより酸性水溶液が多ければ酸性のままに、アルカリ性水溶液が多ければアルカリ性のままでいるんだよ。
じゃあ、ちょうどぴったりの量で混ぜれば中性になるんだよね。

はるか

Haru_You
うん、酸とアルカリの中和でちょうど中性になることを完全中和というんだよ。
中和反応では熱が発生するんだけど、完全中和したときが一番温度が高くなるんだ。
中和反応では熱が発生するんだけど、完全中和したときが一番温度が高くなるんだ。
中和によってできる塩
例えば炭酸水とアンモニア水が中和したらさ、そこに溶けていた二酸化炭素やアンモニアはどこにいっちゃうの?

はるか

Haru_You
どっちもなくなっちゃうよ。
酸とアルカリを構成していた物質が中和すると、互いに反応して新たに塩(えん)と水ができるんだ。
酸とアルカリを構成していた物質が中和すると、互いに反応して新たに塩(えん)と水ができるんだ。
えん?しおとは違うの?

はるか

Haru_You
「しお」も「塩(えん)」の一種だよ。
塩(えん)の中で、食用として使われるものが食塩(しょくえん)で、その食塩のことをわれわれは塩(しお)と呼んでいるんだ。
で、その食塩のことを化学では「塩化ナトリウム」というよ。
塩(えん)の中で、食用として使われるものが食塩(しょくえん)で、その食塩のことをわれわれは塩(しお)と呼んでいるんだ。
で、その食塩のことを化学では「塩化ナトリウム」というよ。
てことは、食塩以外の塩(えん)もあるんだね。

はるか

Haru_You
うん、酸とアルカリの組み合わせの数だけ、塩の種類もあると思っていいよ。
中和した酸とアルカリの名前を見ればどんな塩ができるかわかるんだ。
酸性水溶液が塩酸のときは「塩化」、炭酸や硫酸のときはそのままで、アルカリ性のカタカナの部分、「○○ウム」をくっつけた名前の塩になるんだ。
中和した酸とアルカリの名前を見ればどんな塩ができるかわかるんだ。
酸性水溶液が塩酸のときは「塩化」、炭酸や硫酸のときはそのままで、アルカリ性のカタカナの部分、「○○ウム」をくっつけた名前の塩になるんだ。
塩酸+水酸化ナトリウム水溶液→塩化ナトリウム、炭酸水+水酸化バリウム水溶液→炭酸バリウム、ってことね。
でも、アルカリ性は石灰水とか重そう水みたいに、カタカナがないやつもあるよ?
でも、アルカリ性は石灰水とか重そう水みたいに、カタカナがないやつもあるよ?

はるか

Haru_You
石灰水の溶質は「水酸化カルシウム」だね。
重そうは「炭酸水素ナトリウム」という物質だから、塩酸と中和させると塩化ナトリウムができて、そのとき二酸化炭素も発生するよ。
重そうは「炭酸水素ナトリウム」という物質だから、塩酸と中和させると塩化ナトリウムができて、そのとき二酸化炭素も発生するよ。
石灰水と炭酸水の中和

Haru_You
いま、石灰水の名前がでてきたけど、これが炭酸水と中和するとどんな塩ができると思う?
えーと、炭酸水+水酸化カルシウム→炭酸カルシウム、かな?

はるか

Haru_You
正解。
ところで、「炭酸カルシウム」ってどっかで聞いたことない?
ところで、「炭酸カルシウム」ってどっかで聞いたことない?
えーと、二酸化炭素の発生実験で使うやつだっけ。

はるか

Haru_You
そう、炭酸カルシウム=石灰石の主成分だったよね。
実は、二酸化炭素を石灰水(水酸化カルシウム水溶液)に通して白く濁るのは、炭酸水と石灰水の中和で炭酸カルシウムという塩ができる反応なんだよ。
中和によって発生した炭酸カルシウム=石灰石は水に溶けないから、白く濁って見えるんだ。
実は、二酸化炭素を石灰水(水酸化カルシウム水溶液)に通して白く濁るのは、炭酸水と石灰水の中和で炭酸カルシウムという塩ができる反応なんだよ。
中和によって発生した炭酸カルシウム=石灰石は水に溶けないから、白く濁って見えるんだ。
石灰石から二酸化炭素が発生して、その二酸化炭素を石灰水に通すと、石灰石に戻るんだ。
なんかややこしいな。
なんかややこしいな。

はるか

Haru_You
石灰水が白く濁った後も二酸化炭素を通し続けると、水に二酸化炭素が溶けて炭酸水になるんだ。
この炭酸水が、炭酸カルシウムと反応して炭酸水素カルシウムという水に溶ける物質に変えるから、白く濁った石灰水に二酸化炭素を通し続けると白い濁りが消えるんだよ。
この炭酸水が、炭酸カルシウムと反応して炭酸水素カルシウムという水に溶ける物質に変えるから、白く濁った石灰水に二酸化炭素を通し続けると白い濁りが消えるんだよ。
塩酸と水酸化ナトリウム水溶液の中和
塩酸に水酸化ナトリウム水溶液を加える場合

Haru_You
中和についての問題が試験で出るとき、そのほとんどが塩酸+水酸化ナトリウム水溶液→塩化ナトリウム+水の中和反応に関するものなんだ。
この反応は、塩酸が一定量入ったビーカーに水酸化ナトリウム水溶液を加えていって中和するのと、水酸化ナトリウム水溶液が入ったビーカーに塩酸を加えて中和するのではちょっと異なるのがポイントなんだよ。
この反応は、塩酸が一定量入ったビーカーに水酸化ナトリウム水溶液を加えていって中和するのと、水酸化ナトリウム水溶液が入ったビーカーに塩酸を加えて中和するのではちょっと異なるのがポイントなんだよ。
どっちにしても同じように塩化ナトリウムと水ができるんでしょ?

はるか

Haru_You
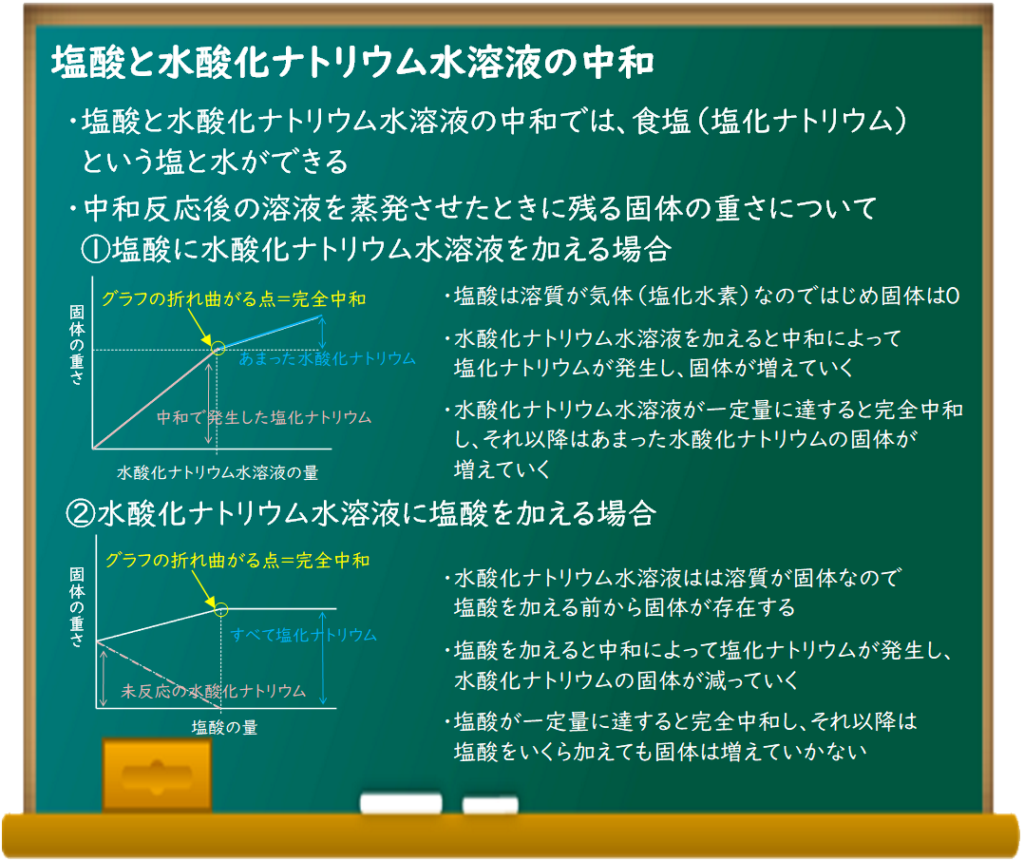
中和の進み方は同じなんだけど、中和後の液体を蒸発させたときに残る固体の重さの変化が異なるんだ。
塩酸の溶質は気体の塩化水素だから、はじめは蒸発させても固体が残らないよね。
だけど、塩酸の入ったビーカーに水酸化ナトリウム水溶液を加えていくと、中和が進んで塩化ナトリウムが発生するから固体が残るようになるんだ。
塩酸の溶質は気体の塩化水素だから、はじめは蒸発させても固体が残らないよね。
だけど、塩酸の入ったビーカーに水酸化ナトリウム水溶液を加えていくと、中和が進んで塩化ナトリウムが発生するから固体が残るようになるんだ。
そしたら、どこかで完全中和するまで固体の量が増えていくよね。

はるか

Haru_You
ところが、完全中和後も固体が増えていくんだ。
完全中和後は水酸化ナトリウム水溶液があまるから、蒸発させるとそこに含まれる水酸化ナトリウムの固体も出てくるんだよ。
ただ、水酸化ナトリウムは塩化ナトリウムより軽いから、グラフにすると固体の増加が緩やかになって折れ曲がる点ができるんだ。
中和の反応グラフでは折れ曲がる点が完全中和ってのをよく覚えておくこと。
完全中和後は水酸化ナトリウム水溶液があまるから、蒸発させるとそこに含まれる水酸化ナトリウムの固体も出てくるんだよ。
ただ、水酸化ナトリウムは塩化ナトリウムより軽いから、グラフにすると固体の増加が緩やかになって折れ曲がる点ができるんだ。
中和の反応グラフでは折れ曲がる点が完全中和ってのをよく覚えておくこと。
水酸化ナトリウム水溶液に塩酸を加える場合

Haru_You
いっぽう、水酸化ナトリウム水溶液の入ったビーカーに塩酸を加えて行く場合、はじめからビーカー内に固体が残ることになるね。
でも、同じように完全中和までは固体の量は増えていくよね。

はるか

Haru_You
そのときの「残った水酸化ナトリウムの重さ」と「発生した塩化ナトリウムの重さ」を計算するのが試験でよく出る問題の1つだね。
また、完全中和後に塩酸を加えても固体の重さは変化しなくなるんだ。
また、完全中和後に塩酸を加えても固体の重さは変化しなくなるんだ。
塩酸には固体が含まれていないもんね。

はるか

Haru_You
それから、蒸発させたあとの固体を顕微鏡で観察する問題もあるんだ。
塩化ナトリウム(食塩)の結晶ってどんな形だったか覚えてるかい?
塩化ナトリウム(食塩)の結晶ってどんな形だったか覚えてるかい?

えーと、食塩は立方体の結晶だっけ。

はるか

Haru_You
そうだね、食塩の結晶は立方体。
ところが立方体以外の結晶が見える場合もあって、そのときは水酸化ナトリウムの棒状の結晶が見えるんだ。
水酸化ナトリウムの結晶が見えている場合、溶液はアルカリ性になっているね。
ところが立方体以外の結晶が見える場合もあって、そのときは水酸化ナトリウムの棒状の結晶が見えるんだ。
水酸化ナトリウムの結晶が見えている場合、溶液はアルカリ性になっているね。
中和計算の例題

中和計算は「比例」に注目

Haru_You
ということで、中和計算の例題を解いてみよう。
BTBとかで完全中和するときがわかればいいけど、この表じゃいつ完全中和したかもわからないよね。
そのうえ、塩酸の量が変わっちゃうんじゃ、どうしようもないなあ。
そのうえ、塩酸の量が変わっちゃうんじゃ、どうしようもないなあ。

はるか

Haru_You
中和の計算は必ず比例を使うからね。
量の変化に対する比例関係を、表から読み取るんだ。
量の変化に対する比例関係を、表から読み取るんだ。
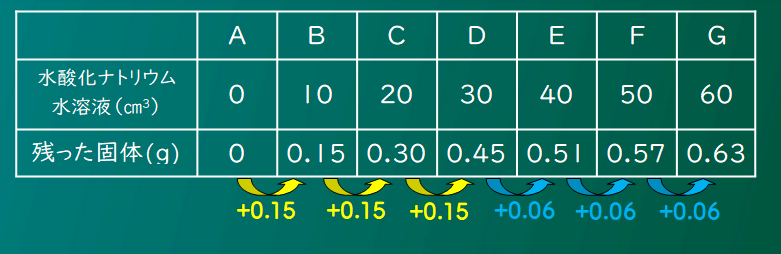
水酸化ナトリウムを10cm3加えるたびに、はじめは固体が0.15g増えているのが、Dからは0.6gずつになるね。

はるか

Haru_You
ということは、これをグラフにしたときにDの点で折れ曲がる、ってことになるだろ。
グラフが折れ曲がる点が、完全中和の点だったよね。
グラフが折れ曲がる点が、完全中和の点だったよね。
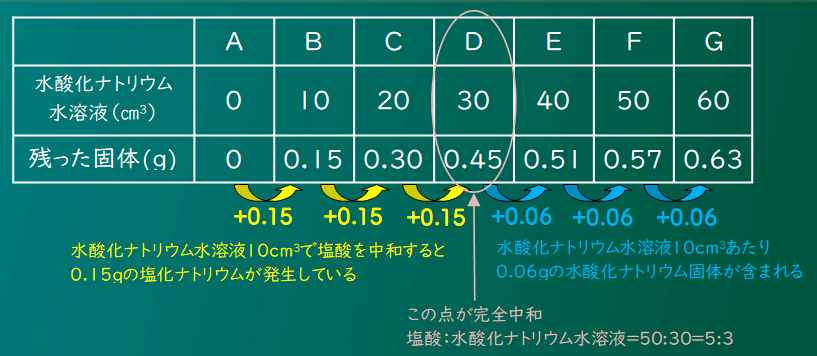
たしかに、変化を見ると水酸化ナトリウム30cm3のところで変わっているのがわかるね。
問題の条件は塩酸50cm3だったから、塩酸:水酸化ナトリウムが5:3で中和するってことがわかったけど・・・
塩酸が30cm3のときの中和に必要な水酸化ナトリウム水溶液の量はどうやって求めたらいいの?
問題の条件は塩酸50cm3だったから、塩酸:水酸化ナトリウムが5:3で中和するってことがわかったけど・・・
塩酸が30cm3のときの中和に必要な水酸化ナトリウム水溶液の量はどうやって求めたらいいの?

はるか

Haru_You
塩酸の量を変えても、完全中和するのに必要な水酸化ナトリウムや発生する個体の量は同じ比になるんだよ。
こんなふうに、比を2つたてに並べて、何倍になっているか計算するのがいいよ。
こんなふうに、比を2つたてに並べて、何倍になっているか計算するのがいいよ。

塩酸の量を0.6倍にしたから、必要な水酸化ナトリウムや中和でできる固体も0.6倍になるってことね。

はるか
中和の量は少ない方にそろえる
次は塩酸80cm3に水ナト40cm3か。
あれ?どっちも完全中和のときと数字が合わないし、塩酸が1.6倍、水ナトが2倍で倍率も合わないや。
あれ?どっちも完全中和のときと数字が合わないし、塩酸が1.6倍、水ナトが2倍で倍率も合わないや。

はるか

Haru_You
完全中和の比とそろわないときは、どっちかが多くて(少なくて)中性にならないってことだね。
こういうとき、中和の反応は酸とアルカリ、どちらかがなくなったら終わっちゃうから、倍率を見比べて小さい方、先になくなる方にそろえて反応させるんだ。
こういうとき、中和の反応は酸とアルカリ、どちらかがなくなったら終わっちゃうから、倍率を見比べて小さい方、先になくなる方にそろえて反応させるんだ。

じゃあ、今回は塩酸のほうが1.6倍で少ないから、反応後に発生する塩化ナトリウムの量もそれに合わせて0.45×1.6=0.72g、かな。

はるか

Haru_You
そこまでは正解なんだけど、この問題では水酸化ナトリウム水溶液が余っているんだ。
だから、反応後には水酸化ナトリウムの固体も出てくるはずだよね。
その量も計算もしないといけないんだよ。
だから、反応後には水酸化ナトリウムの固体も出てくるはずだよね。
その量も計算もしないといけないんだよ。

中和には30×1.6=48cm3の水酸化ナトリウム水溶液を使って、12cm3残ってる。
さっき、水酸化ナトリウム10cm3には0.06gの固体が含まれていたから、12cm3には0.06×1.2=0.072gの水酸化ナトリウムの固体が残る、ってことね。
さっき、水酸化ナトリウム10cm3には0.06gの固体が含まれていたから、12cm3には0.06×1.2=0.072gの水酸化ナトリウムの固体が残る、ってことね。

はるか
水溶液の歌
ここで名前の出てきた11種類の水溶液について、名前と液性、指示薬の色変化、識別方法をまとめた歌がありますので、聞いてみてください。
歌詞カードはこちらからどうぞ。
歌詞カードはこちらからどうぞ。

はるか
水溶液の性質(1) まとめ
・においのある水溶液には塩酸、さく酸水、アンモニア水などがある
・水に溶かしたとき電流を通す物質を電解質といい、電流を通さない(非電解質)水溶液には砂糖水、アルコール水溶液がある
・酸性水溶液は青色リトマス紙を赤く変色し、BTB液を黄色く変色する
・アルカリ性水溶液は赤色リトマス紙を青く変色し、BTB液を青く変色する
・酸性とアルカリ性の水溶液がたがいの性質を打ち消しあうことを中和という
・中和によって生じる物質は塩(えん)と水
・塩酸と水酸化ナトリウム水溶液の中和で塩化ナトリウム(食塩)ができる
水溶液の性質(1) 一問一答演習問題プリント
演習プリントには、Excelファイル版とPDFファイル版があります。
Excelファイル版はリロード・再計算(F8)するたびに数字や配列が変わります。
マクロは使用していませんので、セキュリティ警告はありません。
なお、PDF版では20問の収録ですが、Excel版にはより多くの問題を収録しています。
Excelファイル版はリロード・再計算(F8)するたびに数字や配列が変わります。
マクロは使用していませんので、セキュリティ警告はありません。
なお、PDF版では20問の収録ですが、Excel版にはより多くの問題を収録しています。

はるか
水溶液の性質(1) (PDF版)
1 ファイル 400.70 KB
利用規定です。
本配布ファイルは個人利用に限り自由に使用することができますが、著作権は放棄していません。
学習塾、家庭教師などの商用利用は作成者までご相談ください。
本配布ファイルを利用した事によるいかなる損害も作成者は一切の責任を負いません。
本配布ファイルは個人利用に限り自由に使用することができますが、著作権は放棄していません。
学習塾、家庭教師などの商用利用は作成者までご相談ください。
本配布ファイルを利用した事によるいかなる損害も作成者は一切の責任を負いません。

はるか







ディスカッション
コメント一覧
まだ、コメントがありません