中学受験理科講座 水溶液の性質(2)
水溶液の性質(2) 解説動画
水溶液の性質(2) 一問一答プリントはこちらをクリック
水溶液の分類や、指示薬、中和などの解説はこちらをクリック
金属とその性質

元素と「ニホニウム」

Haru_You
化学ではいろいろな物質名が出てくるけど、どんな物質も「元素」というもので構成されているんだ。
「酸素」や「鉄」は元素名がそのまま物質の名前になっているんだけど、たとえば「紙」という元素はなくって、紙は「酸素」「炭素」「水素」などの元素から構成されているんだよ。
「酸素」や「鉄」は元素名がそのまま物質の名前になっているんだけど、たとえば「紙」という元素はなくって、紙は「酸素」「炭素」「水素」などの元素から構成されているんだよ。
じゃあ、「炭酸カルシウム」ってのは「炭酸」と「カルシウム」からできてるってことかな。

はるか

Haru_You
惜しいな。
「カルシウム」は元素だけど、「炭酸」は元素じゃなくって、「炭素」と「酸素」のこと。
「○酸」ってのはみんな元素単体ではなく、化合物といわれるものなんだ。
中学受験では扱わないから気にしないでいいけど、百科事典や化学の本には「周期表」という、元素の一覧表が載ってるから見てみな。
でもね、その中で原子番号113番に「ニホニウム」ってのがあるのだけ、覚えておいて。
「カルシウム」は元素だけど、「炭酸」は元素じゃなくって、「炭素」と「酸素」のこと。
「○酸」ってのはみんな元素単体ではなく、化合物といわれるものなんだ。
中学受験では扱わないから気にしないでいいけど、百科事典や化学の本には「周期表」という、元素の一覧表が載ってるから見てみな。
でもね、その中で原子番号113番に「ニホニウム」ってのがあるのだけ、覚えておいて。
ニホニウム、ってくらいだから日本人が見つけたんだよね、きっと。
どこに使われてる物質なの?
どこに使われてる物質なの?

はるか

Haru_You
ニホニウムは自然界のどこにもないんだ。
元素を構成している「原子」という細かな粒子があって、その原子を改造することで作り出しているんだよ。
改造して無理矢理つくった原子だから、あっという間に崩壊して別の物質に変化するんだ。
この辺の話は高校化学の範囲に入るから、またの機会にね。
元素を構成している「原子」という細かな粒子があって、その原子を改造することで作り出しているんだよ。
改造して無理矢理つくった原子だから、あっという間に崩壊して別の物質に変化するんだ。
この辺の話は高校化学の範囲に入るから、またの機会にね。
金属元素

Haru_You
で、本題に戻ろう。
元素は今のところ118種類あるんだけど、そのうち80種類ほどが「金属元素」とよばれる、金属特有の性質を持つものなんだ。
元素は今のところ118種類あるんだけど、そのうち80種類ほどが「金属元素」とよばれる、金属特有の性質を持つものなんだ。
金属じゃない方が珍しいくらいだね、そしたら。

はるか

Haru_You
うん、中学受験で名前が出てくる非金属元素は酸素、水素、窒素、塩素、ヨウ素、ヘリウム、アルゴンくらいかな。
それ以外の名前聞いたことあるやつは、ほとんど金属だと思っていいよ。
鉄・金銀銅・アルミニウム・マグネシウム・ナトリウム・亜鉛・水銀・・・みたいなね。
それ以外の名前聞いたことあるやつは、ほとんど金属だと思っていいよ。
鉄・金銀銅・アルミニウム・マグネシウム・ナトリウム・亜鉛・水銀・・・みたいなね。
えーと、炭素は?
あと、アンモニア。
あと、アンモニア。

はるか

Haru_You
炭素は非金属だけど、金属的な性質も持つ半金属(半導体)と言われる物質でね、シリコン(ケイ素)もその仲間。
アンモニアが金属じゃないのは見てわかるだろ、気体なんだから。
アンモニアは水素と窒素が化合してできたものだよ。
アンモニアが金属じゃないのは見てわかるだろ、気体なんだから。
アンモニアは水素と窒素が化合してできたものだよ。
金属の性質

Haru_You
で、金属には共通する性質があってね。
まず、水銀以外の金属は常温ではみんな固体。
まず、水銀以外の金属は常温ではみんな固体。
水銀って、水ってつくくらいだから液体なんだよね。
銀色をした水なんて、昔の人は不思議だっただろうね。
銀色をした水なんて、昔の人は不思議だっただろうね。

はるか

Haru_You
中国の皇帝は、水銀を不老不死の薬と信じて飲んで中毒になったなんて話があるくらいだからね。
次に、金属は金と銅以外、ほとんどが銀白色か灰白色をしてて、みがくと光を反射する金属光沢を持つんだ。
次に、金属は金と銅以外、ほとんどが銀白色か灰白色をしてて、みがくと光を反射する金属光沢を持つんだ。
たしかに、銅でできた10円玉もみがくとピカピカになるもんね。

はるか

Haru_You
それから、金属は引き延ばしたり、薄く広げたりという加工がしやすいんだ。
金属っていうと、固くて加工しにくいってイメージがあるかもしれないけど、木炭より鉄のほうがいろいろ形変えられるだろ。
金属っていうと、固くて加工しにくいってイメージがあるかもしれないけど、木炭より鉄のほうがいろいろ形変えられるだろ。
木炭だと引き延ばせずに砕けちゃうか。

はるか

Haru_You
それから、金属は熱と電気をよく通す。
これは熱の伝わり方の説明でもしたけど、銀>銅>アルミニウム>鉄の順に、熱と電気をよく伝えるんだ。
これは熱の伝わり方の説明でもしたけど、銀>銅>アルミニウム>鉄の順に、熱と電気をよく伝えるんだ。
熱による膨張率はアルミ>銅>鉄だったよね。

はるか

Haru_You
あと、これは燃焼の説明でしたけど、金属はふつう空気中の酸素と結びついてさびるよね。
だけど、金や白金は通常ではさびたりしないから、貴重な金属、貴金属とされてきたんだよ。
だけど、金や白金は通常ではさびたりしないから、貴重な金属、貴金属とされてきたんだよ。
金属をとかす水溶液

塩酸に溶ける金属

Haru_You
塩酸には、アルミニウム、亜鉛、鉄、マグネシウムを溶かす性質があるんだ。
他の金属は溶けないの?

はるか

Haru_You
まあ、高校化学で「金属のイオン化傾向」ってやつを学べば、も少しいろいろ出てくるけど、中学受験で出てくる可能性があるのはその4つだけ。
あと、銀・金・白金といった貴金属類と、銅が塩酸には溶けないってことをしっかり覚えておいてね。
あと、銀・金・白金といった貴金属類と、銅が塩酸には溶けないってことをしっかり覚えておいてね。
塩酸には、ってことは塩酸以外には溶けることもあるの?

はるか

Haru_You
例えば銅は硝酸や濃硫酸といった液体には溶けるんだけど、これもまず中学受験では使わない知識だね。
水酸化ナトリウム水溶液にとける金属

Haru_You
また、水酸化ナトリウム水溶液には、アルミニウムと亜鉛を溶かす性質がある。
亜鉛は水酸化ナトリウム水溶液を加熱しないと溶けにくいんだけど、そこまでの知識はなくてもいいかな。
亜鉛は水酸化ナトリウム水溶液を加熱しないと溶けにくいんだけど、そこまでの知識はなくてもいいかな。
水酸化ナトリウムは、鉄は溶かせないんだね。

はるか

Haru_You
どっちかというと、アルミニウムと亜鉛が酸にもアルカリにも溶ける特別な金属なんだよね。
薄いアルミ片なら、アンモニア水でも時間をかければ溶けるしね。
薄いアルミ片なら、アンモニア水でも時間をかければ溶けるしね。
他のアルカリ性水溶液は?

はるか

Haru_You
金属を溶かす問題で出てくるのは、塩酸と水酸化ナトリウム水溶液だけだよ。
いろいろあるけど、今は気にしないでいいよ。
いろいろあるけど、今は気にしないでいいよ。
金属が溶けて発生する気体

Haru_You
で、金属が溶けるときには、金属の表面から細かい泡が出てくるんだ。
泡ってことは、何かの気体だよね。

はるか

Haru_You
うん、金属が溶けるときには水素が発生しているんだ。
水溶液が塩酸でも水酸化ナトリウム水溶液でも、溶けたのが鉄でもアルミニウムでも、必ず水素が発生するんだ。
ただし、「石灰石」「重曹」(炭酸水素ナトリウム)が出てきたら二酸化炭素の発生だし、「過酸化水素水」(オキシドール)が出てきたら酸素の発生だからね。
水溶液が塩酸でも水酸化ナトリウム水溶液でも、溶けたのが鉄でもアルミニウムでも、必ず水素が発生するんだ。
ただし、「石灰石」「重曹」(炭酸水素ナトリウム)が出てきたら二酸化炭素の発生だし、「過酸化水素水」(オキシドール)が出てきたら酸素の発生だからね。
水素が出てきたってのはどうやっって確かめるの?

はるか

Haru_You
水素は火をつけると、音を立てて燃えるんだ。
そして、その後に水ができるから、試験管の口に水滴がつくことでわかるんだよ。
そして、その後に水ができるから、試験管の口に水滴がつくことでわかるんだよ。
金属が溶けたあとに残るもの

金属を溶かしたあとの液体

Haru_You
金属を溶かしたあとは、塩酸なり水酸化ナトリウム水溶液なりは、その性質を失うんだ。
別の水溶液に変化する、といってもいいね。
別の水溶液に変化する、といってもいいね。
なんで?

はるか

Haru_You
さっき説明した水素は、水溶液の中に含まれていた水素が出ていくことで発生しているからだよ。
金属が溶けているように見えたんだけど、実際には水溶液から水素が出てきてるんだね。

はるか
金属が溶けたあとの固体
食塩水はさ、食塩を水に溶かしても、蒸発させたら食塩がまた取り出せたよね。
金属を溶かした場合はどうなるの?
金属を溶かした場合はどうなるの?

はるか

Haru_You
塩酸や水酸化ナトリウム水溶液に溶かした金属は、元の金属とは異なる物質に変化しているんだ。
だから蒸発させても、もとの固体は出てこないよ。
だから蒸発させても、もとの固体は出てこないよ。
でもさ、水溶液から水素が出て行くんでしょ。
なんで金属が変化しているの?
なんで金属が変化しているの?

はるか

Haru_You
この水素の発生は、水溶液に含まれる水素以外の成分と金属が結びつくから、余った水素が出ていくというしくみなんだ。
塩酸だったら、溶質は塩化水素だから、「塩化」の部分が金属とくっついて別の物質になるってことか。

はるか

Haru_You
うん、塩酸に鉄が溶ければ塩化鉄、アルミニウムが溶ければ塩化アルミニウム、亜鉛が溶ければ塩化亜鉛、マグネシウムが溶ければ塩化マグネシウムだね。
ほんとはアルミニウムの反応はもっと複雑なんだけど、中学受験ではこう思っておいていいよ。
ほんとはアルミニウムの反応はもっと複雑なんだけど、中学受験ではこう思っておいていいよ。
じゃあ、水酸化ナトリウム水溶液のときはどうなるの?

はるか

Haru_You
テトラヒドロキソアルミン酸(四水酸化アルミン酸)ナトリウムという意味不明な名前の物質になるんだけど、忘れていいから。
絶対テストで聞かれないからね。
絶対テストで聞かれないからね。
水溶液と金属の反応
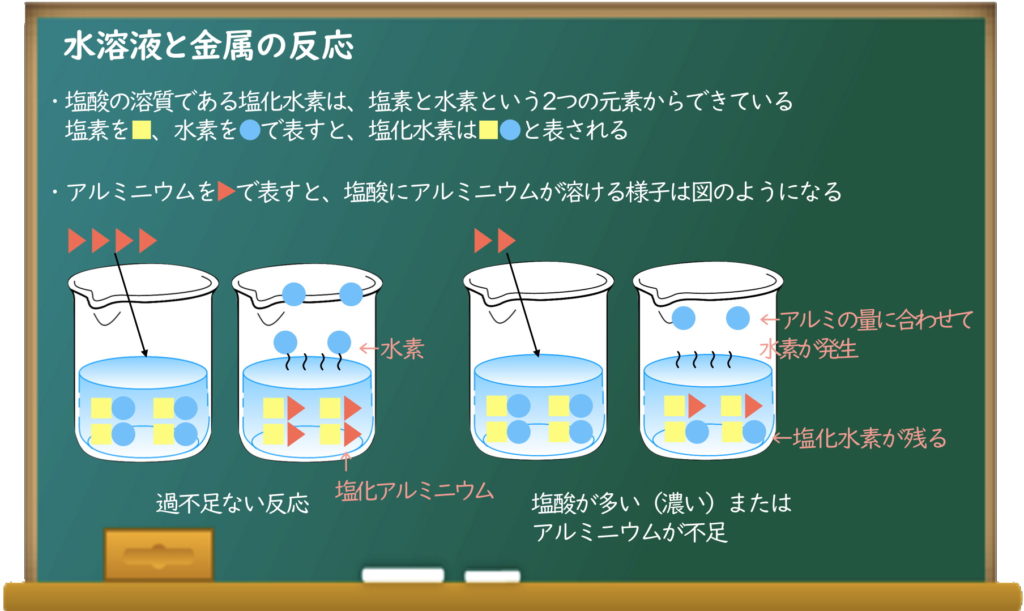
過不足ない反応

Haru_You
塩酸にアルミニウムを溶かしたときのイメージが、●■▶の記号で表したこの図だね。
金属はアルミじゃなくて、亜鉛でも鉄でもマグネシウムでも同じこと。
金属はアルミじゃなくて、亜鉛でも鉄でもマグネシウムでも同じこと。
塩酸の中の塩化水素から、塩素が金属と結びついて水素が追い出されちゃうんだね。

はるか

Haru_You
このとき、塩酸と金属がどちらも余らないように反応するのを「過不足ない反応」というんだ。
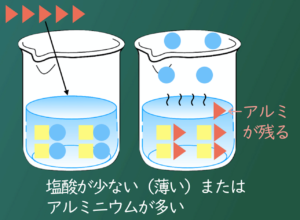
塩酸の量が多かったり、塩酸が濃かったりしたら、金属がすべて溶けても塩化水素が残っちゃうんだね。

はるか

Haru_You
逆に、アルミニウムがたくさんあれば、塩化水素を使い切って、反応していないアルミニウムが溶けずに残るんだよ。
水溶液と金属の反応の計算(1)

グラフの「折れ曲がり点」に注目
テストではこんな風に問題が出るんだね。
グラフと問題文、どっちにも情報があるから混乱するんだよね。
グラフと問題文、どっちにも情報があるから混乱するんだよね。

はるか

Haru_You
まずは、グラフの情報を読み取るんだ。
気体発生グラフで注目するのは、グラフが折れ曲がる点だよ。
気体発生グラフで注目するのは、グラフが折れ曲がる点だよ。
加えたアルミニウムが0.4gのときに、480cm3の水素が発生しているってとこだね。

はるか

Haru_You
このタイプの問題では、水溶液か金属か、どっちかの量は決まっていて、もう一方の量を変化させていくから、必ずどこかで水溶液と金属が過不足なく反応するときがあるんだよ。
それが、このグラフの折れ曲がり点なんだ。
あとは、はじめに決まった量あった水溶液だか金属だかが、どれだけあったのかを問題文から探す。
それが、このグラフの折れ曲がり点なんだ。
あとは、はじめに決まった量あった水溶液だか金属だかが、どれだけあったのかを問題文から探す。
今回は、塩酸が60cm3ってあるね。
てことは、60cm3の塩酸に0.4gのアルミニウムが過不足なく反応したってことか。
てことは、60cm3の塩酸に0.4gのアルミニウムが過不足なく反応したってことか。

はるか
化学の計算は「比例」

Haru_You
過不足ない反応さえ見つければ、あとは設問の条件と見比べるだけだよ。
えーと、塩酸が90cm3になって、アルミニウムが0.5gになってるんだよね。
これをどうしたらいいの?
これをどうしたらいいの?

はるか

Haru_You
さっきの●■▶の図であったとおり、先に金属と水溶液のどっちかがなくなってしまえば、もう一方が余るだけなんだ。
だから、水溶液と金属、それぞれがもとの何倍になっているかを計算して、倍率の小さい、少ない方に合わせて反応させればいいんだよ。
だから、水溶液と金属、それぞれがもとの何倍になっているかを計算して、倍率の小さい、少ない方に合わせて反応させればいいんだよ。
塩酸は60÷40=1.5倍、アルミニウムが0.5÷0.4=1.25倍だから、アルミニウムのほうが少ないってことだね。

はるか

Haru_You
うん、だから発生する気体は、もとの1.25倍、すなわち480×1.25=600cm3って求められるんだよ。
少ない方に合わせて比例、ってルールさえ覚えれば簡単そうだね。

はるか
-1024x612.jpeg)
水溶液と金属の反応の計算(2)

残る固体の計算は「溶け残り」に注意
折れ曲がり点からは0.3gのアルミニウムを20cm3の塩酸に溶かして、蒸発させたら1.5gの固体が残ってたってことがわかるね。

はるか

Haru_You
うん、このとき残ってた固体はなんだかわかるかい?
塩酸にアルミニウムだから、塩化アルミニウムだよね。

はるか

Haru_You
そしたら、折れ曲がり点より右側で固体が増えてるのはなんだと思う?
過不足なく反応したんだから、もう塩化アルミニウムは発生しないよね。
過不足なく反応したんだから、もう塩化アルミニウムは発生しないよね。
確かに、折れ曲がりの右側で固体が増えていってるね。
アルミニウムを0.3→0.5gにしたら、固体が1.5→1.7gだから、アルミニウムが溶けずにそのまま残ったのかな?
アルミニウムを0.3→0.5gにしたら、固体が1.5→1.7gだから、アルミニウムが溶けずにそのまま残ったのかな?

はるか

Haru_You
うん、正解。
残った固体の計算をするときは、溶け残りに注意してね。
残った固体の計算をするときは、溶け残りに注意してね。
「溶け残り」の計算
えーと、塩酸が30÷20=1.5倍で、アルミニウムは0.5÷0.3=1.66・・・倍か。
そしたら、塩酸に合わせて1.5倍だけ反応するんだよね。
そしたら、塩酸に合わせて1.5倍だけ反応するんだよね。

はるか

Haru_You
だから発生する塩化アルミニウムの固体は1.5×1.5=2.25g、だね。
でも、それじゃ正解にならないよ。
でも、それじゃ正解にならないよ。
溶けるアルミニウムも1.5倍だから、0.3×1.5=0.45gしか溶けていないんだよね。
0.5gあったんだから、0.5−0.45=0.05g、溶けないままのアルミニウムが出てくるんだ。
0.5gあったんだから、0.5−0.45=0.05g、溶けないままのアルミニウムが出てくるんだ。

はるか

Haru_You
そうだね、だから全部で2.25+0.05=2.3gの固体が取り出せる、って正解が出るね。
-1024x613.jpeg)
水溶液と金属の反応の計算(3)

中和と金属の組み合わせ問題
今度は塩酸と水酸化ナトリウム水溶液、混ぜちゃうんだ。

はるか

Haru_You
塩酸と水酸化ナトリウム水溶液を混ぜたら、中和して食塩水になるのは前に説明したよね。
完全中和していれば食塩水だけだから、アルミニウムは溶けないはずだよ。
完全中和していれば食塩水だけだから、アルミニウムは溶けないはずだよ。
じゃあ、B液が完全中和しているのか。

はるか

Haru_You
そのときの塩酸と水酸化ナトリウム水溶液の比を考えれば、他の水溶液がどう中和して、どっちが残っているかわかるはずだよ。
塩酸80cm3で水酸化ナトリウム水溶液40cm3を中和するから、2:1の割合で中和しているんだよね。
Aは水酸化ナトリウムが20cm3しかないから、中和できる塩酸は40cm3で、残ってる塩酸が60cm3あるんだ。
Aは水酸化ナトリウムが20cm3しかないから、中和できる塩酸は40cm3で、残ってる塩酸が60cm3あるんだ。

はるか

Haru_You
設問の条件は塩酸60cm3だから、水酸化ナトリウム水溶液を30cm3だけ中和することになるよね。
すると、水酸化ナトリウム水溶液が120−30=90cm3残っていることになるから、それと同じものを探せばいいいよ。
すると、水酸化ナトリウム水溶液が120−30=90cm3残っていることになるから、それと同じものを探せばいいいよ。
E液が塩酸20cm3で水酸化ナトリウム10cm3を中和するから、残り90cm3で同じ量の水酸化ナトリウム水溶液が残るね。

はるか

Haru_You
だから発生する気体もE液と同じ、120cm3になるってことだ。
同じ条件のものがなくても、水酸化ナトリウム水溶液の量に比例させればいいだけだからね。
同じ条件のものがなくても、水酸化ナトリウム水溶液の量に比例させればいいだけだからね。
-1024x576.jpeg)
水溶液の性質(2) 一問一答演習問題プリント
演習プリントには、Excelファイル版とPDFファイル版があります。
Excelファイル版はリロード・再計算(F8)するたびに数字や配列が変わります。
マクロは使用していませんので、セキュリティ警告はありません。
なお、PDF版では20問の収録ですが、Excel版にはより多くの問題を収録しています。
Excelファイル版はリロード・再計算(F8)するたびに数字や配列が変わります。
マクロは使用していませんので、セキュリティ警告はありません。
なお、PDF版では20問の収録ですが、Excel版にはより多くの問題を収録しています。

はるか
水溶液の性質(2)(PDF版)
1 ファイル 656.41 KB
利用規定です。
本配布ファイルは個人利用に限り自由に使用することができますが、著作権は放棄していません。
学習塾、家庭教師などの商用利用は作成者までご相談ください。
本配布ファイルを利用した事によるいかなる損害も作成者は一切の責任を負いません。
本配布ファイルは個人利用に限り自由に使用することができますが、著作権は放棄していません。
学習塾、家庭教師などの商用利用は作成者までご相談ください。
本配布ファイルを利用した事によるいかなる損害も作成者は一切の責任を負いません。

はるか








ディスカッション
コメント一覧
まだ、コメントがありません