中学受験理科講座 水溶液の濃さと溶解度
水溶液の濃さと溶解度 一問一答プリントはこちらをクリック
中学受験理科 オンラインテストはこちらをクリック
溶液の濃さ

「とける」とは
水溶液ってなんだっけ?

はるか

Haru_You
物質が水に均一に溶け、透明でどこも同じ濃さになったものが水溶液だね。
にごった液体は水に溶けない固体が目に見えているってことになるから、水溶液とはよばないんだよ。
にごった液体は水に溶けない固体が目に見えているってことになるから、水溶液とはよばないんだよ。
水溶液はみんな透明なの?
そしたら、水溶液を見た目で判別することは難しいね。
そしたら、水溶液を見た目で判別することは難しいね。

はるか

Haru_You
ほとんどの水溶液は無色透明だから、見ただけじゃわからないね。
だけど、青色の硫酸銅水溶液や、赤色の塩化コバルト水溶液のように色がついていても透明な水溶液もあるんだよ。
あと、溶液にとけている物質のことを溶質、とかした液体のことを溶媒、というのも覚えておいてね
だけど、青色の硫酸銅水溶液や、赤色の塩化コバルト水溶液のように色がついていても透明な水溶液もあるんだよ。
あと、溶液にとけている物質のことを溶質、とかした液体のことを溶媒、というのも覚えておいてね
水以外の液体が溶媒になることもあるの?

はるか

Haru_You
溶媒が水のときは水溶液だし、たとえばアルコールにとかした溶液、アルコール溶液ってのもあるよ。
濃さって?
さっき、濃さって言葉が出てきたけど、濃さってなんなの?
色の濃さじゃないよね。
色の濃さじゃないよね。

はるか

Haru_You
濃さってのは正式には質量パーセント濃度といって、溶液全体の重さに対する溶質の重さの割合のこと。
たとえば、果汁100%のオレンジジュースの中身はすべてオレンジだけど、果汁10%のオレンジジュースってのは中身のうち10%がオレンジ果汁であとは水、みたいな感じだよ。
たとえば、果汁100%のオレンジジュースの中身はすべてオレンジだけど、果汁10%のオレンジジュースってのは中身のうち10%がオレンジ果汁であとは水、みたいな感じだよ。
割合、ってことは、くらべる量÷もとの量で求められるんだよね。

はるか

Haru_You
そうだね。溶質の重さ÷溶液の重さ=濃さになるね。このとき、溶液の重さ=溶質の重さ+溶媒の重さであることを間違えないようにね。
濃さの計算

割合を利用した濃さの計算

Haru_You
何問か濃さの計算をやってみようか。
ここだけでなく、算数文章題講座の「食塩水」もやっておいてね。
まずは単純に100gの水に25gの食塩をとかした場合の濃さを求めてみよう。
ここだけでなく、算数文章題講座の「食塩水」もやっておいてね。
まずは単純に100gの水に25gの食塩をとかした場合の濃さを求めてみよう。
25÷100=0.25・・・かと思わせておいての、25÷(100+25)=0.2→20%だよね。
溶液の重さは溶質25g+溶媒100gだから。
これ、「食塩水」のところで聞かれたのと同じ質問だから覚えてたよ。
溶液の重さは溶質25g+溶媒100gだから。
これ、「食塩水」のところで聞かれたのと同じ質問だから覚えてたよ。

はるか

Haru_You
その通り。
じゃあ、次は30%の塩酸100gを水で薄めて6%にするときに加える水の量を求めてみよう。
じゃあ、次は30%の塩酸100gを水で薄めて6%にするときに加える水の量を求めてみよう。
えーと、30%の塩酸だから、溶質の・・・なんだっけ?

はるか

Haru_You
塩酸の溶質は塩化水素だね。
でもって、濃さの計算は溶質の量に注目する、というのは正解だよ。
でもって、濃さの計算は溶質の量に注目する、というのは正解だよ。
じゃあ、その塩化水素が100×0.3=30g入ってるから、それが6%、0.06にあたればいいんだね。
全体(もとの量)はくらべる量÷割合だから、30÷0.06=500gになればいいので、加える水の量は500-100=400gだ。
全体(もとの量)はくらべる量÷割合だから、30÷0.06=500gになればいいので、加える水の量は500-100=400gだ。

はるか

Haru_You
正解。だけど実際に理科で水溶液を使うときには、別の考え方で薄めるんだよ。
比を利用した濃さの計算

Haru_You
今のように水で水溶液を薄めるとき、理科では「何倍に薄める」という言いかたをするんだ。
30%→6%だったら、5分の1倍ってこと?

はるか

Haru_You
いや、その言いかたは面倒くさいので5倍に薄めるって言うんだ。
薄くなるのに5倍っていうんだね。
いまいちピンと来ないなあ。
いまいちピンと来ないなあ。

はるか

Haru_You
さっきの例題の途中計算を見てごらん。
全体の量が100g→500gになっているんだから、重さが5倍だろ。
全体の量が100g→500gになっているんだから、重さが5倍だろ。
水溶液の重さを5倍になるように薄めると、濃さが5分の1になるってこと?

はるか

Haru_You
そうだね。
溶質の量が一定のとき、溶液の重さと濃さは逆比になるんだ。
溶質の量が一定のとき、溶液の重さと濃さは逆比になるんだ。
じゃあ、もし12%→8%だったら濃さが3分の2倍だから、溶液の重さが2分の3倍になるように水を入れればいいってこと?

はるか

Haru_You
うん、それでいいよ。
実際に薬品を使うときはこの計算方法を使うことが多いから、覚えておいてね。
実際に薬品を使うときはこの計算方法を使うことが多いから、覚えておいてね。
混合溶液の濃さ

50%+50%=100%?

Haru_You
次に、水溶液どうしを混ぜたときの濃さを計算してみよう。
5%の食塩水200gと14%の食塩水100gを混ぜたときの濃さを求めてみようか。
5%の食塩水200gと14%の食塩水100gを混ぜたときの濃さを求めてみようか。
5%+14%=19%、じゃないよね、たぶん。

はるか

Haru_You
果汁50%のジュースどうしを2本混ぜても、100%ジュースにはならないのはわかるよね。
濃さどうしをたし算することはできないんだ。
濃さどうしをたし算することはできないんだ。
じゃあ、さっきと同じように溶質の重さから計算してくか。
200×0.05=10gと、100×0.14=14gだから合わせて10+14=24gの食塩がとけてるんだよね。
食塩水は全部で200+100=300gになったから、24÷300×100=8%かな。
200×0.05=10gと、100×0.14=14gだから合わせて10+14=24gの食塩がとけてるんだよね。
食塩水は全部で200+100=300gになったから、24÷300×100=8%かな。

はるか

Haru_You
うん、正解。
じゃあ、今の8%って解答の意味を考えてみようか。
じつは、問題文を読んだ時点でこのくらいの濃さになるってのは予想がつくんだよ。
じゃあ、今の8%って解答の意味を考えてみようか。
じつは、問題文を読んだ時点でこのくらいの濃さになるってのは予想がつくんだよ。
なんで予想できるの?

はるか

Haru_You
濃さの違う2種類の食塩水を混ぜたとき、濃さは2つの食塩水の濃さの間の数字になるのは当然じゃないかな?
その考えを発展させたものが、てんびん図なんだよ。
その考えを発展させたものが、てんびん図なんだよ。
てんびん図による濃さの計算
5%と14%の間になるのはわかるけど、ちょうどまん中の(5+14)÷2=9.5%でもなかったよね。
どうやったら8%ってわかるの?
どうやったら8%ってわかるの?

はるか

Haru_You
今の問題だと、薄いほう、5%の食塩水が多かったよね。
だったら混ぜた後の濃さはまん中の9.5%よりも薄くなると思わない?
だったら混ぜた後の濃さはまん中の9.5%よりも薄くなると思わない?
たしかに。

はるか

Haru_You
そこでてんびんの図を書くんだ。
てんびんの両端が混ぜる前の食塩水で、上側(腕の長さ)に濃さを、下側に重さを書き込む。
てんびんの両端が混ぜる前の食塩水で、上側(腕の長さ)に濃さを、下側に重さを書き込む。
てんびんのまん中に支点を置くと、重い方に傾いちゃうよね。

はるか

Haru_You
その支点の位置が混ぜた後の濃さになるから、重い方に支点を近づければいいんだよ。
どのくらい近づければいいの?

はるか

Haru_You
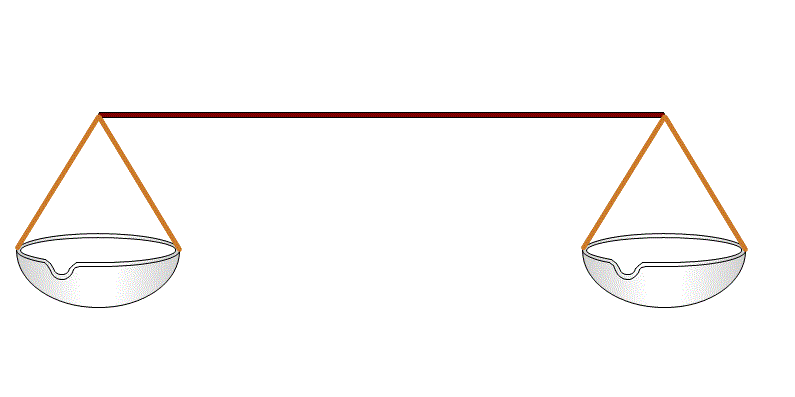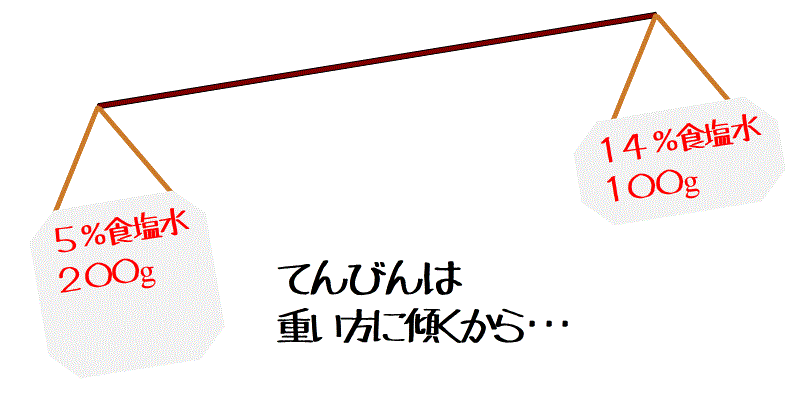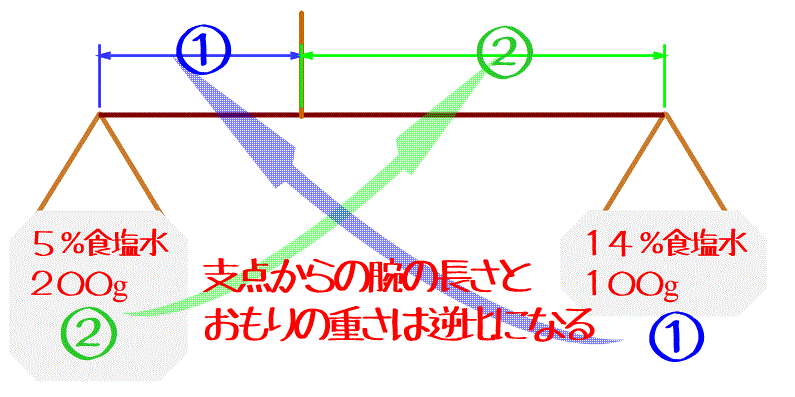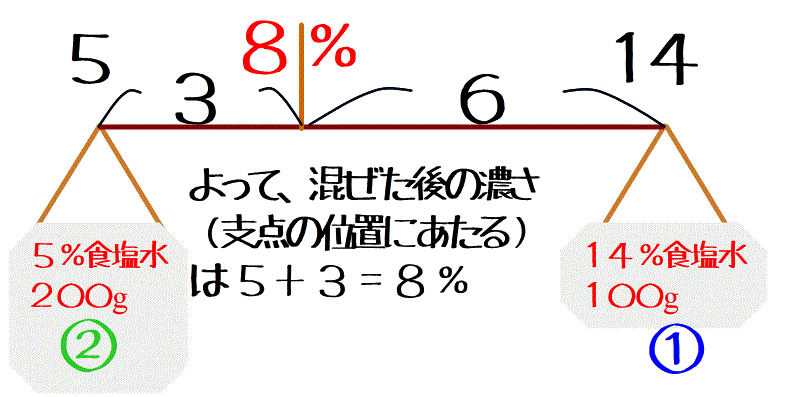
このとき、支点からの腕の長さ(濃さの差)と両端の重さ(溶液の重さ)は逆比になるんだ。
この問題なら、腕の長さ(濃さの差)は14-5=9%だから、9%を重さ2:1の逆比1:2に比例配分した場所が支点の位置=混ぜた後の濃さだよ。
この問題なら、腕の長さ(濃さの差)は14-5=9%だから、9%を重さ2:1の逆比1:2に比例配分した場所が支点の位置=混ぜた後の濃さだよ。
ということは左端の5%の位置から9÷(1+2)×1=3%だけ動かせばいいから、8%になるってことだね。

はるか
濃さと重さと体積の関係

水溶液の体積

Haru_You
水100gに食塩10gをとかすと、重さはどうなると思う?
当然、110gになるよね。
とけて見えなくなってもそこにあるんだから。
とけて見えなくなってもそこにあるんだから。

はるか

Haru_You
そうだね、水溶液をつくると水と溶質の重さは合計されるんだ。
じゃあ、水100g=100cm3に、食塩10g=およそ4.3cm3をとかすと、体積はどうなると思う?
じゃあ、水100g=100cm3に、食塩10g=およそ4.3cm3をとかすと、体積はどうなると思う?
うーん・・・、とかしても体積は変わらない気がするけど・・・。

はるか

Haru_You
これがね、水溶液をつくると水だけのときより体積も増加するんだよ。
ただし、単純に合計にはならず、わずかに体積が増加するだけなんだ。
ただし、単純に合計にはならず、わずかに体積が増加するだけなんだ。
濃さと重さ

Haru_You
じゃあ、10%の食塩水と20%の食塩水を同じ体積ずつとったら、どっちが重くなると思う?
水溶液にしても体積はわずかにしか増加しないんだから・・・。
たくさんとけてる20%の食塩水のほうが重いんじゃないかな。
たくさんとけてる20%の食塩水のほうが重いんじゃないかな。

はるか

Haru_You
正解。同じ体積なら濃い食塩水のほうが重くなるんだ。
じゃあ、10%のアンモニア水と20%のアンモニア水だったらどっちが重いかな?
じゃあ、10%のアンモニア水と20%のアンモニア水だったらどっちが重いかな?
え、それは20%のアンモニア水じゃないの?

はるか

Haru_You
ところがね、この場合は10%のアンモニア水のほうが重いんだ。アンモニアやアルコールなど、溶質が水より軽い物質のときは、同じ体積なら濃い溶液のほうが軽くなるんだ。
溶解度


飽和と溶解度

Haru_You
水にとかすことができる溶質でも、際限なくとけるわけではないことはわかるよね。
うん、食塩を水にとかしていくととけ残りがでるもんね。

はるか

Haru_You
とけ残りがでる、ということは限界までとけたということだね。
その限界までとけた状態が飽和(ほうわ)といって、飽和している水溶液を飽和水溶液というよ。
その限界までとけた状態が飽和(ほうわ)といって、飽和している水溶液を飽和水溶液というよ。
飽和するときの濃さって、どれくらいの濃さなの?

はるか

Haru_You
水にとける限度量は物質によって異なるから、一概には言えないね。
食塩水なら26%くらいだけど、砂糖水は60%以上になるよ。
食塩水なら26%くらいだけど、砂糖水は60%以上になるよ。
そっか、砂糖のほうが食塩より水にとけやすいもんね。

はるか

Haru_You
100gの水にとける限度量のことを溶解度といって、物質ごとに決まっているんだ。
この溶解度は水の量に比例するから、ある水温の水100gへの溶解度が15gの物質なら、水200gには30gとけることになるんだよ。
この溶解度は水の量に比例するから、ある水温の水100gへの溶解度が15gの物質なら、水200gには30gとけることになるんだよ。
じゃあさ、食塩と砂糖を同時に水にとかしたら、溶解度はどうなるの?

はるか

Haru_You
2種類以上の物質をとかしても、それぞれの溶解度には影響がないんだ。
その場合、食塩は食塩の溶解度まで、砂糖は砂糖の溶解度までとけることになるね。
その場合、食塩は食塩の溶解度まで、砂糖は砂糖の溶解度までとけることになるね。
水温と固体の溶解度
さっき、ある水温っていったけど、温度によっても溶解度はかわるの?

はるか

Haru_You
うん、たとえば粉末のココアやコーヒーを、水に溶くのとお湯に溶くのとでは、とけぐあいに差があるだろ?
味噌汁の味噌やカレーのルーもそうだし。
味噌汁の味噌やカレーのルーもそうだし。
そっか、水の温度が高いほうがよくとけるね。

はるか

Haru_You
うん、例外の物質を除いて溶質が固体のときには水温が高いほうが溶解度が大きくなるんだ。
で、例外になるのが水酸化カルシウム、その水溶液が石灰水なんだけど、水酸化カルシウムだけは水温が低いほうが溶解度が大きくなるよ。
で、例外になるのが水酸化カルシウム、その水溶液が石灰水なんだけど、水酸化カルシウムだけは水温が低いほうが溶解度が大きくなるよ。
水酸化カルシウム以外の溶解度は水温に比例するの?

はるか

Haru_You
いや、溶解度曲線というグラフを見てわかるとおり、水温が高くなると溶解度も大きくなるけど比例ではないんだ。
食塩のように水温の変化で溶解度が変わりにくい物質もあれば、ホウ酸のように水温の変化で溶解度が大きく変わる物質もあるよ。
食塩のように水温の変化で溶解度が変わりにくい物質もあれば、ホウ酸のように水温の変化で溶解度が大きく変わる物質もあるよ。
液体の溶解度

Haru_You
続いて、溶質が液体の場合の溶解度だけど・・・
溶質が液体ってどういうこと?
もとから液体だったら、水にまざって薄まるだけじゃないの?
もとから液体だったら、水にまざって薄まるだけじゃないの?

はるか

Haru_You
そうだね、アルコールや酢酸などの液体が水にとけるってのは水で薄めるのと同じ意味だね。
だから溶解度はなく無制限に水に溶けるんだ。
だけど油のように水とまざらず分離する液体もあるよね。
物質によっては水にとけない液体もあるってことなんだけど、その物質名は小学生の理科ではまず出てこないから気にしないでいいよ。
だから溶解度はなく無制限に水に溶けるんだ。
だけど油のように水とまざらず分離する液体もあるよね。
物質によっては水にとけない液体もあるってことなんだけど、その物質名は小学生の理科ではまず出てこないから気にしないでいいよ。
気体の溶解度

Haru_You
次に気体の溶解度だけど、気体は水温が低いほうが溶解度が大きいんだよ。
固体と気体で溶解度の性質が違うんだね。
でも、気体にしたって水温が高いほうがよくとけそうな気がするんだけどなあ。
でも、気体にしたって水温が高いほうがよくとけそうな気がするんだけどなあ。

はるか

Haru_You
サイダーを暖かいとこにおいとくと、中の炭酸が抜けちゃうだろ?
あれは温度が上がって、二酸化炭素が水中にとけられなくなって出て行くからなんだ。
あれは温度が上がって、二酸化炭素が水中にとけられなくなって出て行くからなんだ。
そっか、中から出てくる泡はとけられなくなった二酸化炭素なんだ。
たしかに、冷たいほうが炭酸は強くなるもんね。
たしかに、冷たいほうが炭酸は強くなるもんね。

はるか
溶質の取り出しかた

結晶

Haru_You
最後に、水にとけた固体の溶質を再び取り出すことを考えてみよう。
とけちゃったから、元と同じ状態には戻らないよね。

はるか

Haru_You
そうだね、溶媒にとかした物質が固体として取り出されたものは、結晶という規則正しい形の立体になるんだ。
食塩の結晶は立方体、ホウ酸の結晶は六角形みたいに、形が決まってるんだね。

はるか

Haru_You
顕微鏡で見ないとわからないけどね。
あと、水酸化ナトリウムは棒状の結晶になるんだけど、中和実験のさいにその結晶が残るときはアルカリ性になるって決め手になるから覚えておいてね。
あと、水酸化ナトリウムは棒状の結晶になるんだけど、中和実験のさいにその結晶が残るときはアルカリ性になるって決め手になるから覚えておいてね。
溶質による取り出しかたの違い

Haru_You
で、結晶を取り出すにはどうしたらいいか、思いつくかな?
水にとけた固体を取り出すんだから、水を全部蒸発させちゃえばいいんじゃない?

はるか

Haru_You
うん、水溶液を蒸発させれば結晶を取り出すことができるね。
でも、水を全部蒸発させるのは面倒だし、2種類以上の溶質を分けて取り出すことができないから、もう1つの方法が必要になるんだ。
でも、水を全部蒸発させるのは面倒だし、2種類以上の溶質を分けて取り出すことができないから、もう1つの方法が必要になるんだ。
もう1つの方法って?

はるか

Haru_You
ホウ酸のように水温による溶解度の変化が大きい物質なら、水溶液の温度を下げればとけきれなくなった溶質が結晶として出てくるんだよ。
水温を下げるだけで出てくるから簡単だし、溶質が2種類以上あるときはどちらか一方だけを結晶にすることもできるんだ。
水温を下げるだけで出てくるから簡単だし、溶質が2種類以上あるときはどちらか一方だけを結晶にすることもできるんだ。
だけど、食塩は水温を下げても溶解度があまり変わらないよね。

はるか

Haru_You
うん、だから食塩の結晶を取り出したい場合は、水溶液を蒸発させるんだよ。
物質の溶解度曲線を見て、温度による溶解度の変化が小さいときは蒸発、大きいときは冷やす、と使い分けるんだ。
物質の溶解度曲線を見て、温度による溶解度の変化が小さいときは蒸発、大きいときは冷やす、と使い分けるんだ。
溶解度の計算

溶解度曲線の読み取り

Haru_You
じゃあ、溶解度曲線を使って結晶が出てくる量を計算してみよう。
60℃のホウ酸飽和水溶液100gを20℃まで冷ましたとき、結晶の出てくる量は何gになるかな?
60℃のホウ酸飽和水溶液100gを20℃まで冷ましたとき、結晶の出てくる量は何gになるかな?
溶解度曲線から、水温ごとのとける量を読み取ればいいんだよね。

はるか

Haru_You
うん、溶解度曲線の水温ごとの溶解度の差が、その温度まで冷ましたときの結晶の量だよ。
じゃあ、60℃で14.9g、20℃で4.9gだから、14.9-4.9=10.0gの結晶が出てくるってことかな。

はるか

Haru_You
正解。
水量が100gじゃない場合、水量に溶解度は比例するから100gのときの結晶の量を計算して、水量に比例させれば計算が簡単にできるよ。
水量が100gじゃない場合、水量に溶解度は比例するから100gのときの結晶の量を計算して、水量に比例させれば計算が簡単にできるよ。
水溶液の濃さと溶解度 まとめ
・水溶液の濃さ=溶質の重さ÷溶液の重さ(×100で%に直す)
・濃さの異なる2種類の水溶液は「てんびん図」で混ぜた後の濃さを求める
てんびん図では「重さと腕の長さが逆比」!
・物質が限度までとけることを飽和といい、100gの水にとける限度量のことを溶解度という
・固体の溶解度は温度が高いほど大きくなるが、水酸化カルシウム(石灰水)だけは温度が低い方がよくとける
・気体の溶解度は温度が低いほど大きくなる
・溶液にとけた固体を結晶として取り出すには、溶液を蒸発させるか、温度を下げて溶解度を小さくする
水溶液の濃さと溶解度 一問一答演習問題プリント
演習プリントには、Excelファイル版とPDFファイル版があります。
Excelファイル版はリロード・再計算(F8)するたびに数字や配列が変わります。
マクロは使用していませんので、セキュリティ警告はありません。
なお、PDF版では20問の収録ですが、Excel版にはより多くの問題を収録しています。
Excelファイル版はリロード・再計算(F8)するたびに数字や配列が変わります。
マクロは使用していませんので、セキュリティ警告はありません。
なお、PDF版では20問の収録ですが、Excel版にはより多くの問題を収録しています。

はるか
水溶液の濃さ(PDF版)
1 ファイル 237.88 KB
利用規定です。
本配布ファイルは個人利用に限り自由に使用することができますが、著作権は放棄していません。
学習塾、家庭教師などの商用利用は作成者までご相談ください。
本配布ファイルを利用した事によるいかなる損害も作成者は一切の責任を負いません。
本配布ファイルは個人利用に限り自由に使用することができますが、著作権は放棄していません。
学習塾、家庭教師などの商用利用は作成者までご相談ください。
本配布ファイルを利用した事によるいかなる損害も作成者は一切の責任を負いません。

はるか









ディスカッション
コメント一覧
まだ、コメントがありません